近日,我校化学与分子工程学院包春燕教授课题组在超分子自组装人工离子通道研究领域取得了重要进展,相关成果以“Self-assembled K+ ion channel constructed by a Janus-type self-complementary molecule”为题,发表在Science Bulletin上。
细胞膜上存在各种各样的功能蛋白,负责控制能量转换、物质运输、信息识别和传递等功能。其中,离子通道蛋白主要负责细胞内外亲水性无机离子的跨膜运输,通过开/闭状态调节细胞内外离子浓度差,从而参与细胞的众多生理过程,包括细胞的电位变化、神经传导、肌肉收缩等。因此,离子通道蛋白的结构和功能异常与许多疾病的发生和发展有关。为了理解离子通道蛋白的工作机制和治病机理,研究人员尝试利用简单的人工合成体系去模拟其结构和功能,为相关疾病诊断、发现特异性治疗药物提供理论基础。
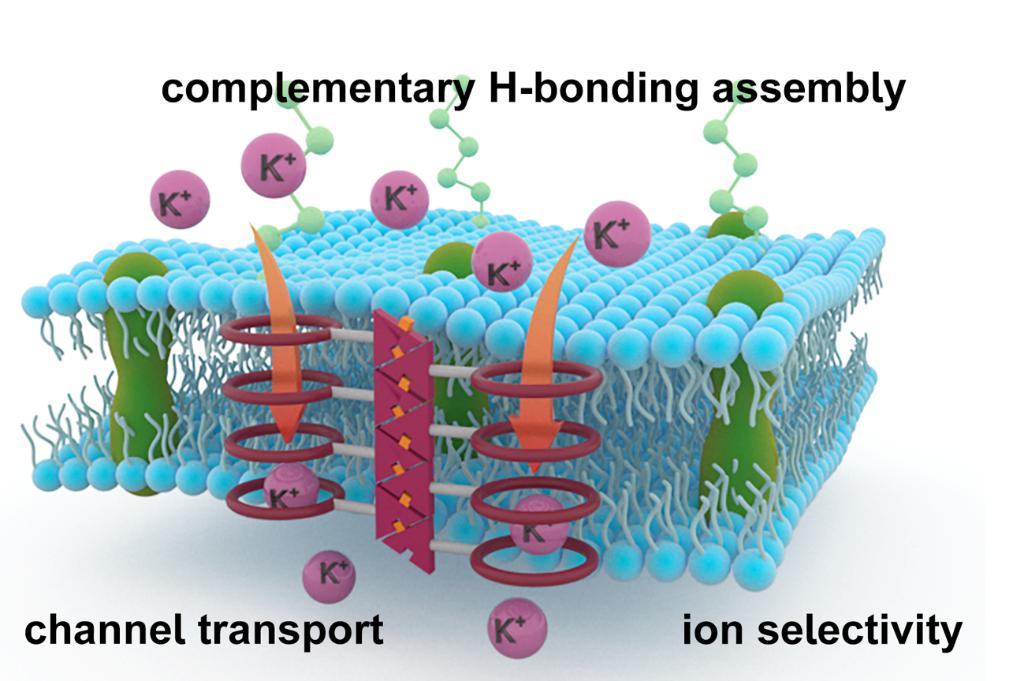
与合成复杂的单分子离子通道相比,利用超分子作用构建的自组装通道具有更为简单的分子结构,在化学合成和进一步修饰调控离子传输性能方面具有得天独厚的优势。受DNA/RNA互补氢键自组装启发,包春燕教授课题组设计合成了一种简单的“两面神”型碱基衍生物小分子,通过定向和互补的氢键相互作用,促使分子在磷脂膜中形成反平行带状组装,引导两侧悬挂的冠醚基团上下排列形成离子通道。实验和理论计算研究表明,小体积带状自组装促使分子有效插入磷脂双分子层形成通道,介导高效和选择性的钾离子跨膜转运,并通过在细胞膜上形成超分子通道有效触发癌细胞内钾离子的外流,从而通过破坏细胞内外离子电势平衡,诱导癌症细胞凋亡。这项工作巧妙地利用了“两面神”超分子自互补氢键作用构建了体积小巧的人工离子通道,为开发更高效、更具选择性的人工离子通道提供新视角,并为抗癌新药的研发提供理论依据。
论文由化学与分子工程学院费林加诺贝尔奖科学家联合研究中心博士生庞施浩在包春燕教授的指导下完成,文中理论计算模拟部分由吉林大学赵莉副教授所在团队完成。该研究成果得到了国家自然科学基金、上海市科技重大项目以及上海市细胞代谢光遗传学技术前沿科学研究基地等资金的支持。
原文链接:https://www.sciencedirect.com/science/article/pii/S2095927325001276?dgcid=author