近日,我校化学与分子工程学院、费林加诺贝尔奖科学家联合研究中心贺晓鹏教授团队发展了基于“振动诱导发光”(Vibration-Induced Emission, VIE)机制的超级细菌精准分型探测工具,相关工作发表于《美国化学会志》(J. Am. Chem. Soc.2023, 145, 8917)。随着抗生素的滥用,临床超级细菌的出现严重危害人类生命健康,因而对于超级细菌的精准探测与分型有助于感染的早期诊治。传统微生物检测技术包括脉冲场凝胶电泳、多位点序列分型和SCCmec分型等,然而这些技术存在操作繁复、耗时长、对仪器设备要求高等缺陷,制约了它们在感染即时诊断中的实用性。
前期工作中,贺晓鹏研究团队与美国德克萨斯大学奥斯汀分校Jonathan L. Sessler教授团队合作,构建了基于FDA批准铁螯合剂药物Deferasirox的多色荧光传感阵列,利用不同细菌物种对该系列衍生物弱差异化的相互作用结合主成分分析技术,实现了不同细菌的有效区分(J. Am. Chem. Soc. 2022, 144, 7382; J. Am. Chem. Soc.2021, 143, 1278—ESI高被引论文)。
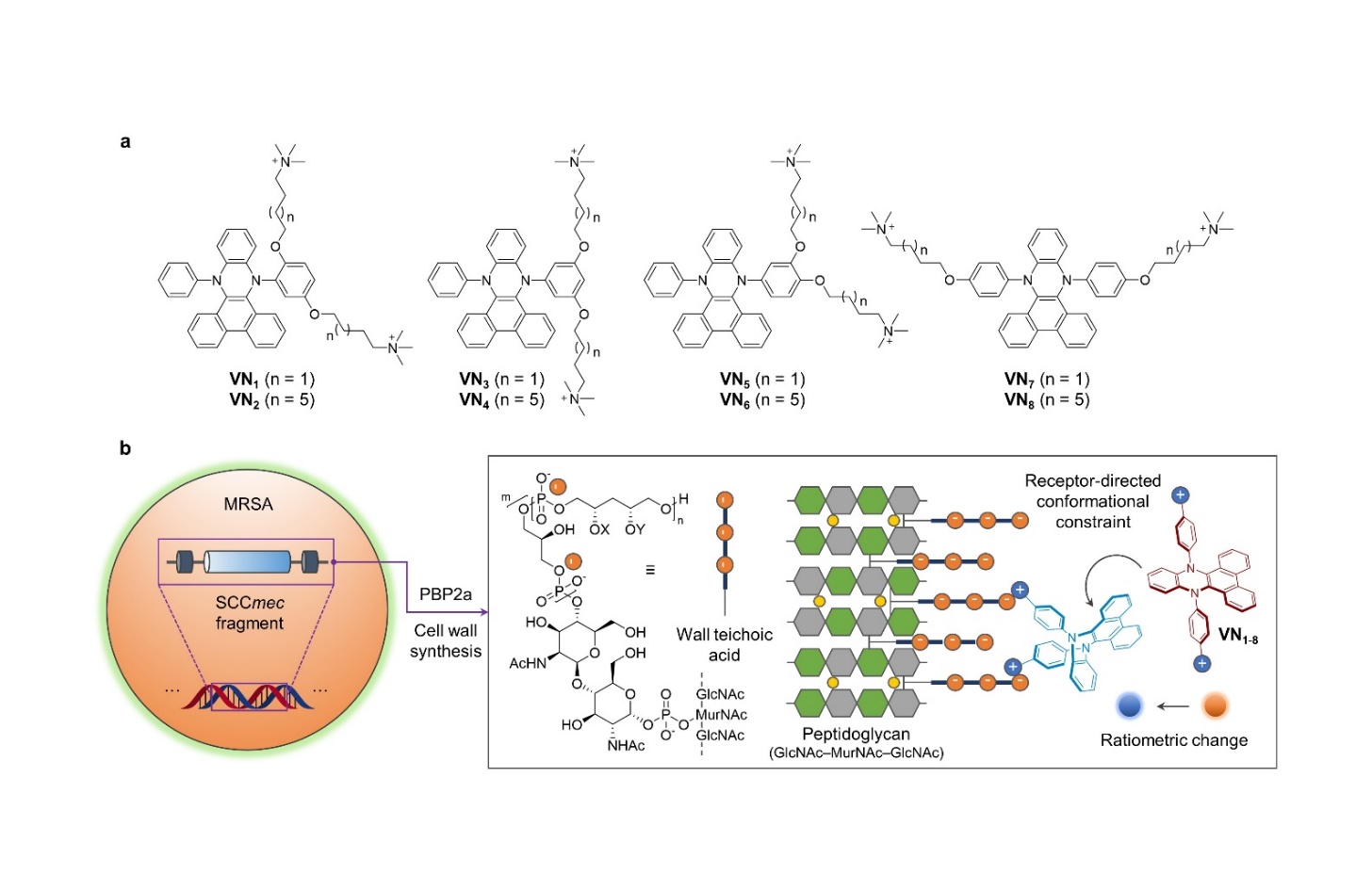
在上述研究工作基础上,团队进一步针对不同基因型超级细菌细胞壁结构的细微差异,构建了基于VIE机制的细菌荧光传感阵列(见图)。细菌的细胞壁肽聚糖拓扑结构受内源性青霉素合成蛋白(PBP)的精细调控,细菌耐药可导致PBP突变,从而影响肽聚糖及其内含磷壁酸的微观结构。针对这一动态改变的细胞壁结构特征,研究团队设计构建了系列取代位点及连接桥长度不同的双季铵盐修饰VIE传感阵列,通过探针季铵盐官能团的差异化空间分布,结合主成分降维分析VIE探针库的双重荧光发射强度比例变化,在不破坏细胞壁完整结构的条件下,实现了不同基因型耐甲氧西林金黄色葡萄球菌(MRSA)磷壁酸微观结构差异的特征识别。
团队根据待测客体菌株的不同生物学特征,通过载荷图分析优化了探针阵列的主体个数,最终确定了不同待测样本的最佳VIE传感阵列组成,实现了革兰氏阳性菌与阴性菌株、药物敏感MRSA与耐药MRSA菌株,尤其是临床分离不同基因型MRSA菌株的高通量、精确区分,该技术有望为高致病病原微生物的灵敏、即时诊断及临床用药辅助判断提供全新化学工具。同时,该研究工作也在团队前期成功构建流感病毒物种VIE传感阵列的基础上(Chem 2022, 8, 1750),进一步验证了VIE这一动态荧光机制适用于结构尺度更大细菌物种的精准传感。
化学与分子工程学院青年教师胡习乐与博士研究生甘慧麒为本文共同第一作者,美国德克萨斯大学奥斯汀分校Jonathan L. Sessler教授、上海交通大学医学院附属仁济医院检验科主任李敏研究员、上海交通大学药学院陈代杰教授与贺晓鹏教授为本文共同通讯作者,研究工作得到了田禾院士的悉心指导。本研究获得了国家自然科学基金“生物大分子动态修饰与化学干预”重大研究计划重点支持项目、集成项目,材料生物学与动态化学教育部前沿科学中心,上海市科技重大专项,上海市科委国际合作项目,中央高校基本业务费等资助。
原文链接:https://pubs.acs.org/doi/10.1021/jacs.2c12798