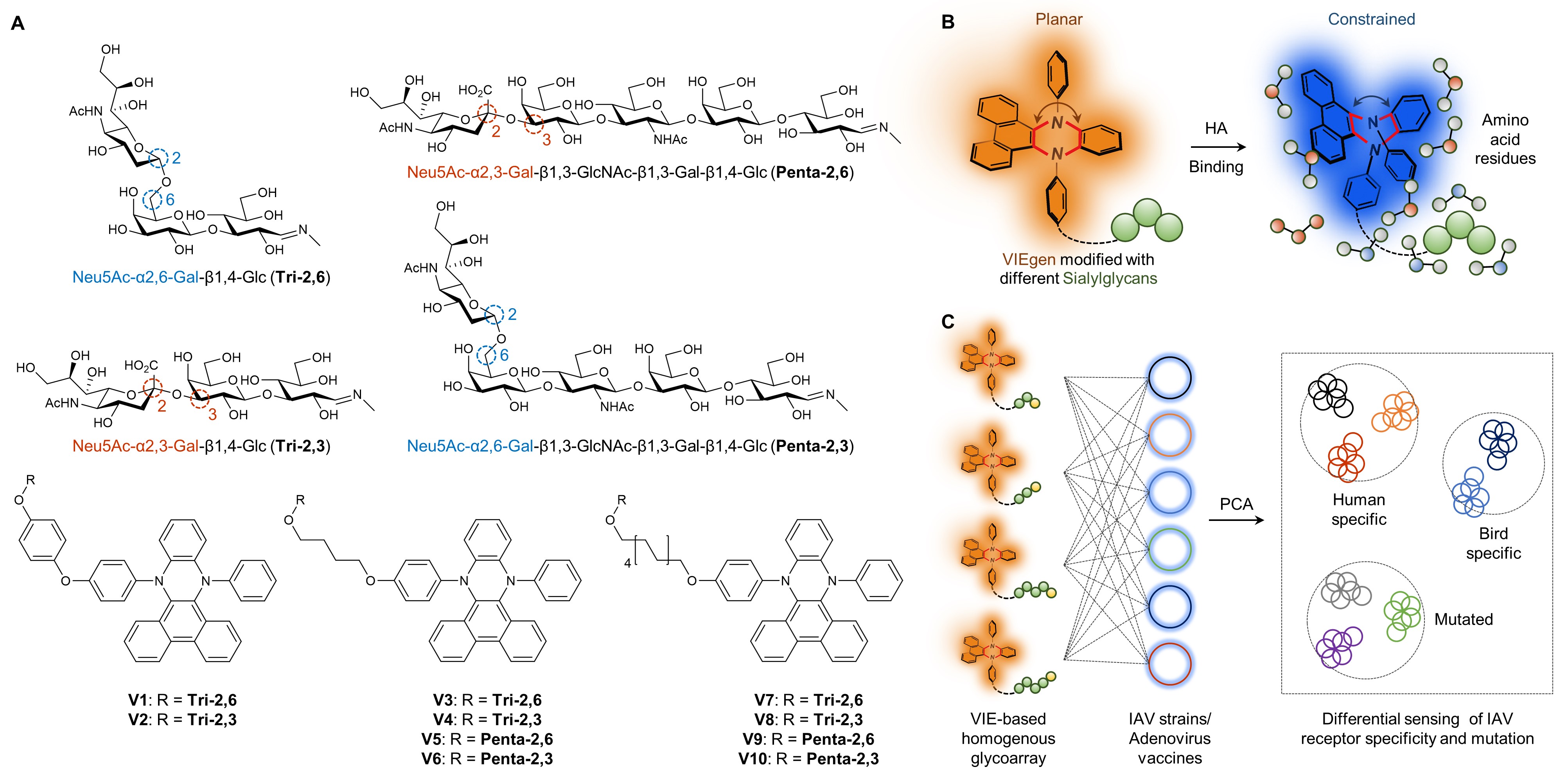
近日,我校化学与分子工程学院、费林加诺贝尔奖科学家联合研究中心贺晓鹏教授团队发展了基于“振动诱导发光”机制的流感病毒精准探测工具,相关工作在线发表于Cell子刊Chem(2022, 10.1016/j.chempr.2022.03.012)。高致病病原微生物往往通过选择性识别宿主细胞表面的特殊糖结构入侵细胞,继而造成感染。例如,时下全球性流行的新冠病毒表面刺突蛋白可经由宿主细胞表面糖胺聚糖的介导,特异性识别血管紧张素转化酶2感染宿主细胞。此外,季节性爆发的甲型流感病毒(IAV)可通过血凝素(HA)膜蛋白识别禽类细胞表面的α-2,3构型唾液酸寡糖感染禽细胞,而当HA的识别特征突变为高表达于人细胞表面的α-2,6构型唾液酸寡糖时,可导致IAV的人感染并大幅增加人传人风险。
传统生化手段需对病毒样本裂解进而分析相关生物标志物,虽然糖固相微阵列技术的提出为糖与蛋白质的选择性识别提供了通用检测方法,然而适用于原位探测糖细微结构差异如何介导其生物识别特异性动态变化的精准化学工具仍相对缺乏。针对这一问题,研究团队以不同糖识别特征的甲型流感病毒为研究模型,提出“生物识别诱导构象限制”策略,发展了基于“振动发光”(VIE)机制的唾液酸寡糖偶联动态荧光阵列。
VIE是我校田禾院士团队独立揭示的一种存在于二氢二苯并吩嗪类结构的发光特征(Tian et al., J. Am. Chem. Soc.2015, 137, 8509),当此类分子处于良分散态时,其激发态呈平面共轭构象,发射红色荧光,而当分子受周边微环境限制“振动”(僵化)时,激发态呈类“马鞍形”构象,荧光显著蓝移。受这一独特“动态发光”机制启发,研究团队设计构建了多系列不同α-2,6和α-2,3-唾液酸聚糖区域异构体修饰的VIE探针库,结合荧光光谱、生物小角度散射和计算模拟等手段,证明糖与病毒识别蛋白间的选择性主客体作用可引导临近偶联的VIE分子“限制振动”(构象僵化),从而呈现探测信号红色至蓝色荧光的比率型改变。该技术无需对病毒裂解并提取目标生物大分子,可直接在均相中实现完整病毒表面糖识别膜蛋白的原位高通量探测,VIE分子受周边微环境限制所发生的动态荧光改变,为其共价偶联糖分子的特异性生物识别环境提供了表征信号,结合主成分分析法对所得高通量信号进行降维解析,实现了不同种属病毒间,人感染和禽感染病毒间,以及不同病毒变体间糖识别特征的精准区分,同时此验证该方法还适用于克隆不同糖识别特异性HA的腺病毒疫苗载体检测,为病毒的糖介导动态识别特征改变的原位探测提供了简易、高效的化学手段。
团队在上述系统性工作中,提出了将“振动诱导发光”这一动态荧光机制引入糖介导高致病病原微生物识别特异性的精准探测,通过“生物识别诱导构象限制”这一独特策略的运用,实现了流感病毒糖异构化识别差异的高通量、原位精准区分,预期该技术有望成为传统固相糖阵列实验的重要补充,为糖组学解码提供有力的化学工具。
化学与分子工程学院博士后豆伟涛与复旦大学附属公共卫生临床中心王祥博士为本文共同第一作者,美国德克萨斯大学奥斯汀分校Jonathan Sessler教授、天津医科大学周东明教授与贺晓鹏教授为本文共同通讯作者,研究工作得到了田禾院士的悉心指导。小角度散射实验得到了蛋白质科学研究(上海)设施五线六站(BL19U2)李娜博士的指导,计算模拟实验由上海科技大学刘婷婷博士完成,并得到了赵素文研究员的指导。本研究获得了国家自然科学基金、材料生物学与动态化学教育部前沿科学中心、上海市科技重大专项、上海市科委国际合作项目、费林加诺贝尔奖科学家联合研究中心博士后创新人才支持计划、上海市超级博士后基金资助。