轴烯是一类含有环外双键的星形环状分子,具有交叉共轭的π-电子结构,展现出区别于共轭烯烃的独特光电性质。三轴烯是最小的轴烯,具有平面结构,是苯环的异构体,但其π-电子共轭模式不同,是研究共轭效应与分子功能之间关系的代表性结构基元。由于三元碳环的高张力,热力学上形成三元碳环不利,三轴烯及其衍生物的高效合成是合成化学领域的难点之一。目前已报道的合成策略主要有两种:1)直接在含有三元碳环的分子骨架中引入环外双键;2)通过预先合成的偕二卤代烯烃的逐步脱卤偶联形成三元碳环。尽管这两种合成策略均能实现三轴烯的合成,但是需要冗长的多步合成,并且生成三轴烯的总产率较低。

示意图
在理想情况下,通过不饱和基团的[1+1+1]环加成反应可以直接合成三轴烯。然而,目前[1+1+1]环加成反应还没有被报道,其主要的挑战是:1)如何控制三个反应物分子中具有高构象自由度的不饱和基团处在同一平面,并且可以协同生成三个C–C键;2)如何调控反应物的反应路径仅产生三元碳环结构。
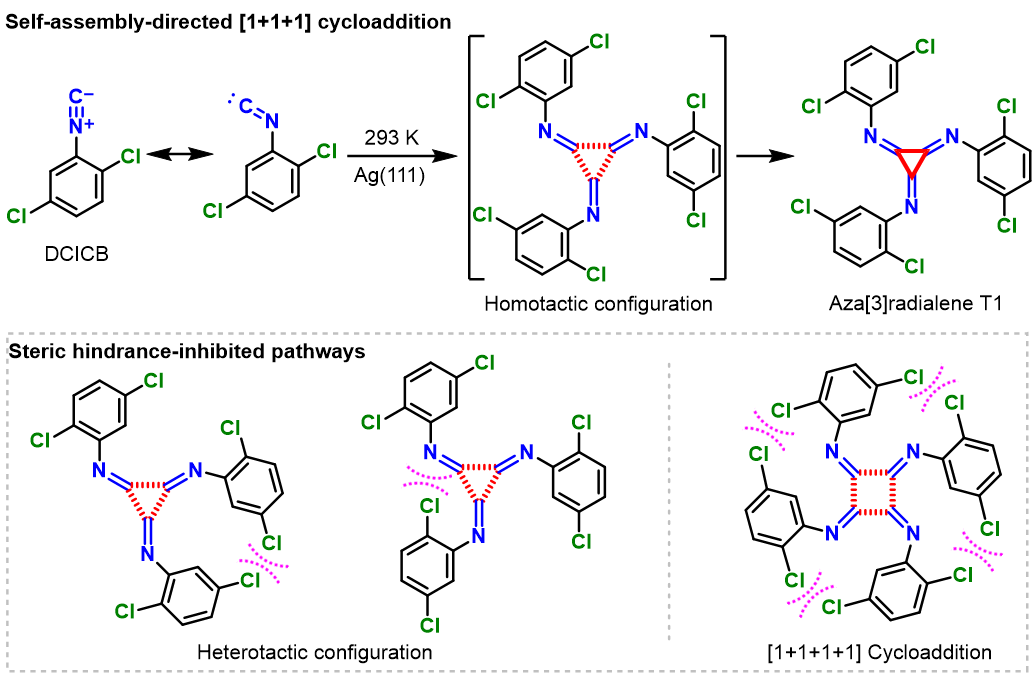
图1. 通过表面[1+1+1]环加成反应合成氮杂[3]轴烯
近日,我校化学与分子工程学院的刘培念教授/李登远副教授团队和国家纳米中心的裘晓辉研究员/刘梦溪副研究员团队及河北大学的石兴强教授团队合作,针对[1+1+1]环加成反应的难点,提出降维合成的方法。即在金属单晶表面进行[1+1+1]环加成反应,利用二维表面的限域效应降低反应物分子中不饱和基团的构象自由度,使反应基团的HOMOs和LUMOs共平面,加速环加成反应的发生。在此基础上,进一步发展了取代基团位阻调控策略,发展出高选择性的一步生成三元碳环的[1+1+1]环加成反应,率先实现了异腈前体分子向氮杂三轴烯的定向转化(图1)。

图2. 基于DCICB的[1+1+1]环加成在Ag(111)上合成氮杂三轴烯分子基元
首先,选用1,4-二氯-2-异氰苯(DCICB)为反应前体分子,Ag(111)为限域表面。在超高真空条件下,将DCICB蒸镀到室温的Ag(111)基底上,通过扫描隧道显微镜(STM)和非接触原子力显微镜(nc-AFM)在超高的化学键分辨率下对[1+1+1]环加成反应的产物进行化学结构的实空间精确表征,并通过飞行时间二次离子质谱(ToF-SIMS)确定了产物的分子量,结合密度泛函理论(DFT)计算证实了产物的化学结构和立体构型(图2)。
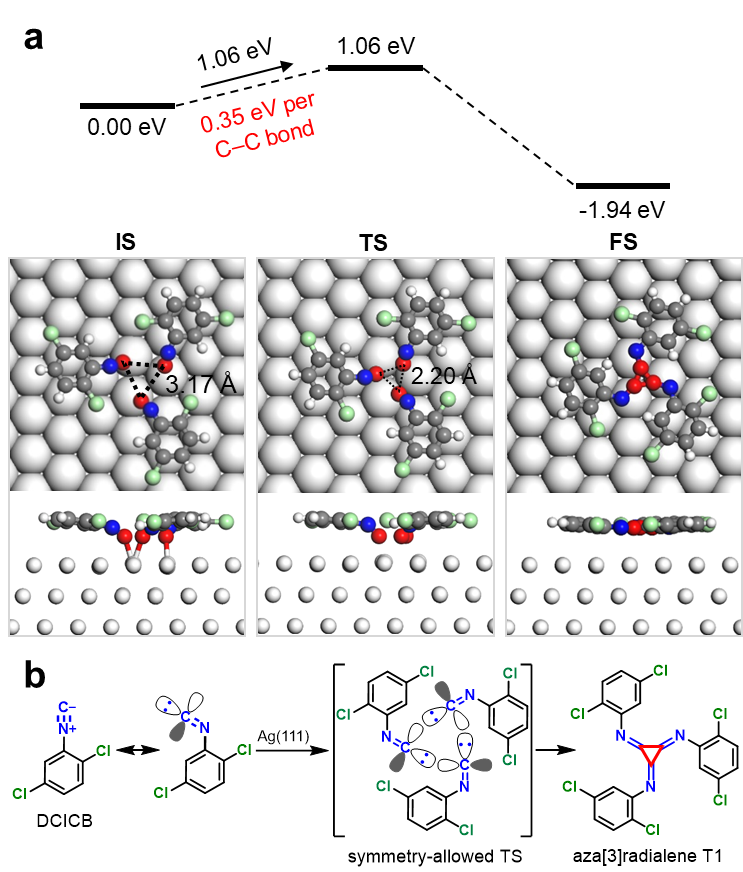
图3.表面[1+1+1]环加成的协同反应路径
在确定了[1+1+1]环加成反应产物的几何结构和立体构型基础上,进一步通过密度泛函理论(DFT)计算模拟了两种可能的反应路径,即通过协同或逐步反应形成三个C–C键。两个反应路径的初态均是前体分子DCICB通过分子间弱相互作用组装形成的同手性三聚体,其平面吸附构象和同向构型促进了异氰基末端碳的HOMO和LUMO之间的相互作用,有利于形成前线轨道理论中对称性允许的过渡态。对于协同反应路径,DFT计算显示形成三个C–C键的能垒为1.06 eV,平均形成一个C–C键的能垒为0.35 eV(图3)。对于逐步反应路径,逐个形成C–C键的最高能垒是0.45 e V,而同时形成两个C–C键的能垒是0.79 eV,平均形成一个C–C键的能垒为0.39 eV。此外,[1+1+1]环加成反应是一个放热的过程,总能量降低约2 eV。考虑到形成每个C–C键的能垒都很低,因此在室温的反应条件下两种反应路径都是可行的。
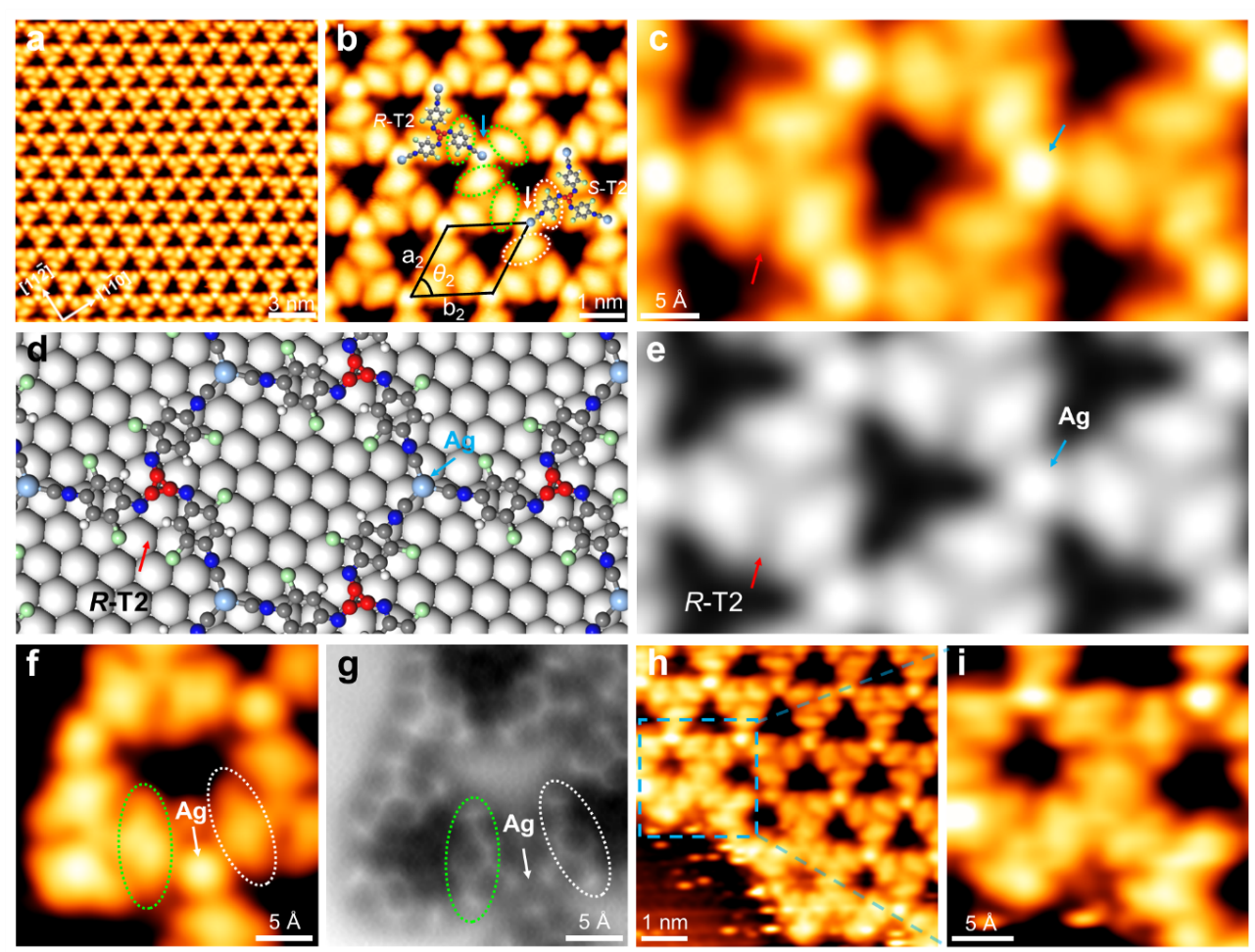
图4. 基于DCDICB的[1+1+1]环加成在Ag(111)上合成二维氮杂三轴系分子体系
为了合成由氮杂三轴烯分子基元组成的二维分子体系,作者进一步设计合成了包含有两个异氰基的前体分子1,4-二氯-2,5-二异氰苯(DCDICB)。将DCDICB沉积在Ag(111)表面上形成了具有三角孔型二维结构。进一步通过STM、nc-AFM和DFT的结合,确定了三角孔型结构是由氮杂三轴烯分子基元通过三重对称的C3−Ag联接结构形成了金属-有机网格(图4)。此外值得注意的是,在三角孔型金属-有机网格的边界处,也观察到了由多个氮杂三轴烯分子基元共价连接的低聚物。
相关成果近期以“On-Surface Synthesis of [3]Radialenes via [1+1+1] Cycloaddition”为题发表在Angew. Chem. Int. Ed. 2022, doi/10.1002/anie.202117714. 该研究工作建立的[1+1+1]环加成反应新模式,为发展高选择性的表面环化反应提供了新思路,并为表面合成新型低维纳米分子体系提供了新的途径。
论文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202117714