近期,我校贺晓鹏教授课题组在分子组装材料的生物医学应用领域取得阶段性研究进展,相关成果连续发表于《美国化学会志》与《德国应用化学》。
临床上多重耐药菌(超级细菌)的顽固性感染已成为威胁医院ICU病患生命安危的首要因素之一,然而传统抗生素的研发过程却大大滞后于细菌耐药性的产生,于是如何发展高效、新颖的非抗生素型抑菌策略成为了全球生物医药从业者所面临的重大挑战性难题。基于上述关键临床问题,研究人员通过分子自组装技术,发展了1)基于结构可控新材料的分子自组装靶向抑菌材料,及2)基于环糊精的自组装抗菌肽微球,实现了多种革兰氏阳性与革兰氏阴性超级细菌的体外与在体杀灭。
基于前期糖基二维自组装材料构建及其光动力学与光热双模式抗绿脓杆菌的工作基础(Adv. Funct. Mater.2019, 29, 1806986),研究团队与上海交通大学麦亦勇教授合作,合成了结构可控的石墨烯纳米带材料,验证了其优异的光热性能(Angew. Chem. Int. Ed.2018, 57, 3366),并进一步与韩国梨花女子大学Juyoung Yoon教授合作,合成了阳离子型卟啉衍生物,通过静电、-堆叠等非共价相互作用,构建了石墨烯纳米带/卟啉复合材料,通过一系列体外与在体实验证明,该材料可经由电荷吸引结合到细菌表面,进而通过光诱导纳米带的光热性能与卟啉光动力学性能,协同抑制一系列革兰氏阳性与革兰氏阴耐药菌的生长,并进一步实现了小鼠表皮感染超级细菌的高效清除,其性能优于临床常规抗生素药物(下图)。上述工作为临床超级细菌感染提供了一类非抗生素型抗菌材料,相关成果发表于《德国应用化学》(Angew. Chem. Int. Ed.2020, DOI: 10.1002/anie.201913506)。

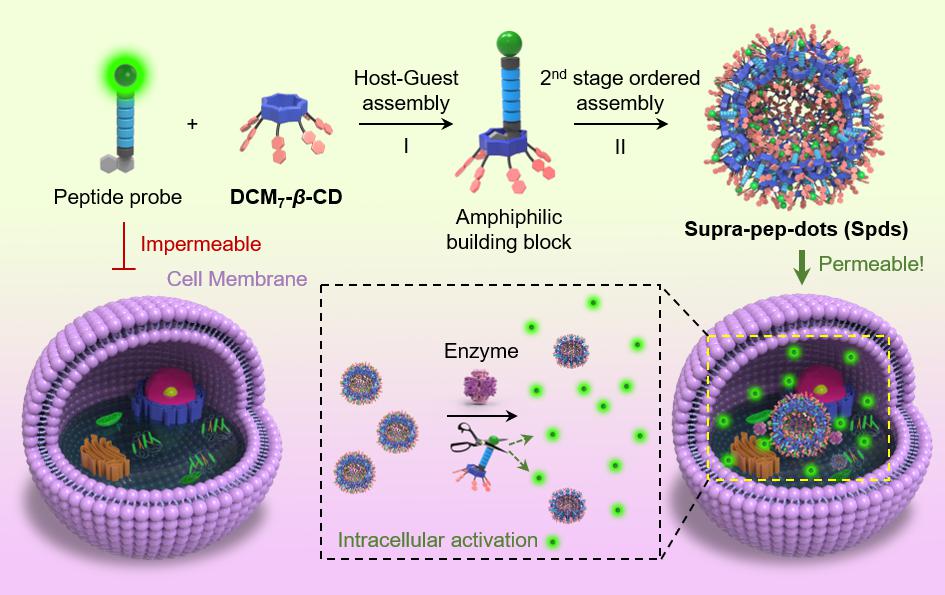
近年来抗菌肽的发展得到了生物医药行业的广泛关注,然而生物活性多肽化合物一般具有膜透性与体内稳定性不佳的缺陷,基于上述问题,研究团队与法国卡尚高等师范学校Juan Xie教授、美国德克萨斯大学奥斯汀分校Jonathan Sessler教授合作,合成了吡喃腈衍生物修饰的环糊精与萘溴/荧光素双修饰的抗菌肽,利用萘溴与环糊精的主客体自组装和随后发生的双亲性自组装,构建了荧光激活型抗菌肽微球。相比未组装的抗菌肽,所构建的多肽微球可实现金黄色葡萄球菌与大肠杆菌的增强荧光标记,并表现出对两种细菌更强的抑菌效果。此外,该策略还被证明适用于细胞凋亡与细胞有丝分裂的增强荧光标记,从而验证此类形貌可控的多肽微球体系有利于细胞摄取(下图)。上述工作发表于《美国化学会志》(J. Am. Chem. Soc.2020, DOI: 10.1021/jacs.9b11207)。
以上工作为对抗临床超级细菌提供了新的化学策略。此外,研究团队与合作者受邀在《化学会综述》(Chem. Soc. Rev.2020, DOI: 10.1039/c8cs00118a)和《先进功能材料》(Adv. Funct. Mater.2020, 10.1002/adfm.201907906)发表靶向型分子探针与组装材料的生物医学应用综述,贺晓鹏教授还获得了2020年度Thieme Chemistry Journals Award。上述研究工作得到了田禾院士的悉心指导,相关生物学与微生物学工作得到了中科院上海药物研究所李佳研究员、臧奕研究员和上海交通大学陈代杰教授的指导与支持,研究工作主要由本校毕业研究生余智豪、矫金彪,青年教师胡习乐博士等协作完成,工作得到了国家自然科学基金重大研究计划、优秀青年科学基金,上海市科技重大专项、上海市国际合作与交流项目、“111”引智计划等资助。