p53蛋白通路参与细胞周期以及细胞凋亡的调控,其表达异常与细胞的肿瘤化密切相关,p53蛋白一直是近年来生命科学领域的研究热点。我校化学院龙亿涛教授科研小组近期在单细胞内p53蛋白原位成像检测的领域取得了突破性进展,《德国应用化学》近日在线报道了该工作“Dual-Targeting Nanovesicles for In Situ Intracellular Imaging of and Discrimination between Wild-type and Mutant p53”(Angew. Chem. Int. Ed. 2015, DOI: 10.1002/anie.201510142)
文章链接:http://onlinelibrary.wiley.com/doi/10.1002/anie.201510142/abstract)。
p53是一种分子量为53kD的肿瘤抑制蛋白,具有反式激活功能和广谱的肿瘤抑制作用。在肿瘤细胞内,p53蛋白通常会发生变异,干扰细胞的正常生长调控机制。因此,原位检测细胞内p53蛋白的表达对肿瘤的监测和诊疗具有重要意义。该工作制备了一种可同时检测细胞内野生型和变异p53蛋白的纳米囊泡,囊泡内部包裹有能特异性识别野生型p53蛋白的纳米金,同时囊泡表面修饰有异硫氰酸荧光素标记的抗变异p53蛋白抗体。囊泡进入细胞后,采用等离子体共振成像以及荧光成像技术,利用显微镜对细胞内p53蛋白进行原位成像,可以实现单细胞层面上野生型和变异p53蛋白的同时成像检测。以HeLa细胞为模型,该工作展示了活细胞内p53蛋白的分布图,发现变异p53蛋白在肿瘤细胞内过表达,而正常p53蛋白受到抑制。该发现表明了p53蛋白通路异常与肿瘤发生之间存在一定的关联机制,为研究p53蛋白参与的生物通路以及发展p53蛋白相关的抗肿瘤药物提供了新方法。
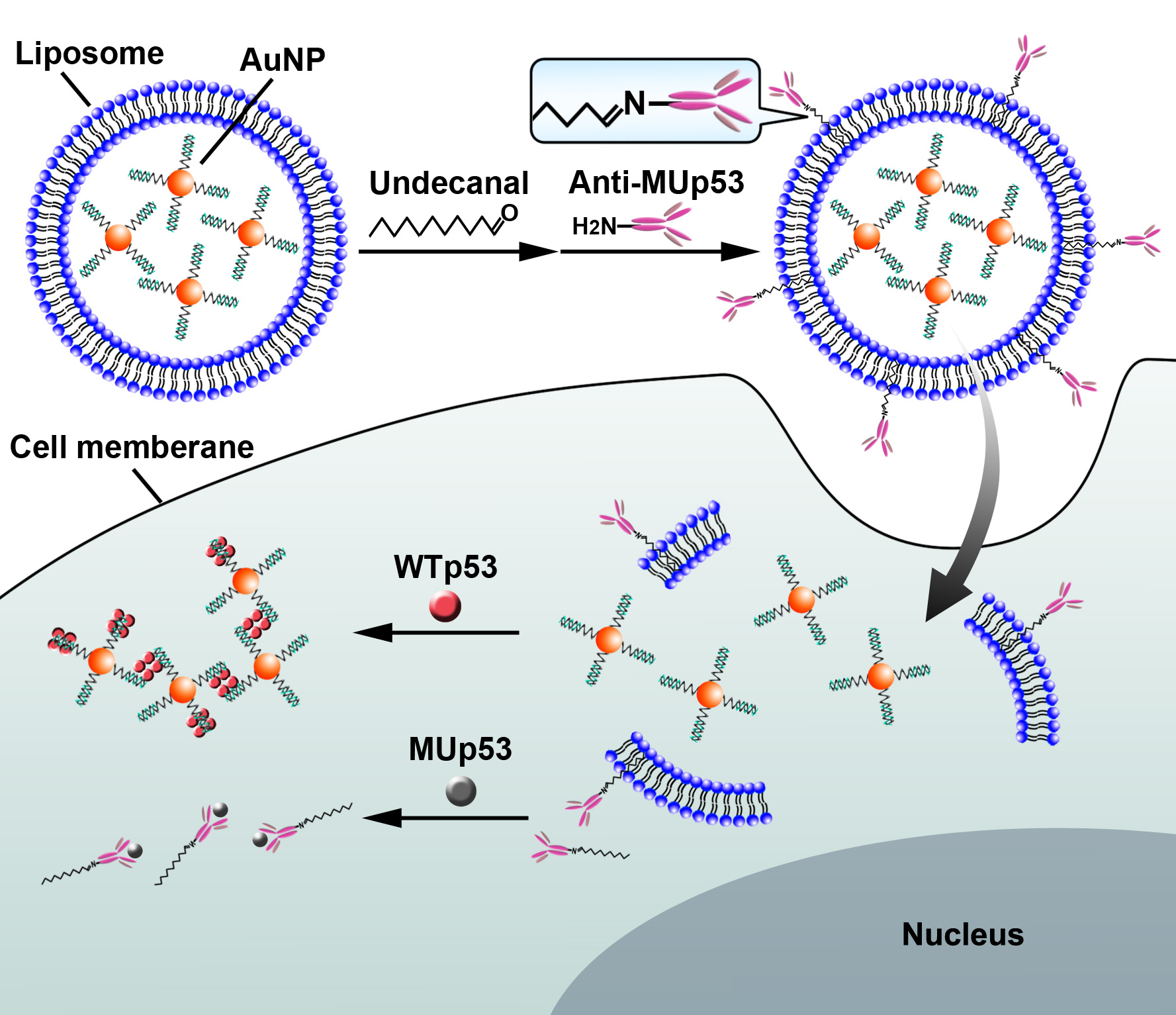
该工作由钱若灿博士和曹玥博士完成。该研究在国家重大仪器设备专项资助搭建的暗场纳米光谱与成像仪器装置平台上完成,利用新型的复合纳米载体实现了活细胞内p53蛋白的原位成像分析。
本研究工作得到了田禾院士领衔的国家“973”项目、龙亿涛教授领衔的国家自然科学基金“创新研究群体”等项目的资助。